Санаторно-курортная реабилитация детей с ожирением
Обследованы 132 ребенка с метаболическим синдромом и ожирением. Выявлены особенности клинико-метаболического, гормонального и психологического статуса у наблюдаемых больных. Разработан немедикаментозный комплекс реабилитации детей и подростков с данной патологией, способствующий коррекции выявленных нарушений.
Ожирение в настоящее время является распространенной патологией в детском возрасте: до 25% подростков имеют избыточную массу тела (МТ), а у 15% обнаруживается ожирение, которое сопровождается патологическими нарушениями со стороны многих органов и систем [1]. Ожирение является основой, на которой формируется метаболический синдром (МС). Доказано, что в основе повышения артериального давления (АД), дислипидемии и инсулинрезистентности (ИР), ведущей в дальнейшем к развитию сахарного диабета 2-го типа (СД2), лежат метаболические нарушения, закономерно наблюдающиеся у больных ожирением [2]. Несмотря на то, что понятие метаболического инсулинрезистентного синдрома с конца 1980-х годов прочно вошло в терапевтическую практику, проблема чаще рассматривалась как относящаяся к взрослому периоду жизни. Результаты проведенных на рубеже XX–XXI веков научных исследований, отражающие педиатрические аспекты МС, подтвердили, что нарушения в рамках синдрома ИР начинают формироваться задолго до их клинической манифестации — еще в детском и подростковом периоде, а многочисленные метаболические осложнения формируются в более поздние периоды жизни человека [3].
На фоне ожирения в детском и пубертатном возрасте развивается артериальная гипертензия (АГ), сопровождаемая нарушениями гемодинамики. Кровоснабжение тканей существенно влияет на обмен веществ в них. В реализации гемодинамических нарушений участвуют калликреин-кининовая и ренин-ангиотензиновая системы (РАС) [4]. Калликреин (КК), катализирующий образование брадикинина, относится к вазодилататорам, ангиотензинпревращающий фермент (АПФ), образующий ангиотензин II и разрушающий брадикинин способствует сужению просвета сосудов. α1-протеиназный ингибитор (α1ПИ) и α2-макроглобулин (α2МГ) контролируют системы протеолиза плазмы крови [4, 5]. Активация РАС является одним из важных механизмов, лежащих в основе патогенеза АГ и МС. В литературе имеются данные, что гиперреактивность РАС сопровождается усилением ИР [6]. Известно, что ИР, основная составляющая МС, развивается на фоне вазоконстрикции [7]. Увеличение в плазме крови концентрации триацилглицеридов и общего холестерина (ХС) приводит к увеличению активности АПФ [8]. Изучение роли гуморальных факторов в патогенезе ожирения у детей имеет значение при проведении лечебных и реабилитационных мероприятий. Основными методами лечения ожирения являются немедикаментозные мероприятия: диета, увеличение физической нагрузки, назначение аппаратной физиотерапии, гидротерапии [1,9–11]. Наиболее приемлемым в плане получения максимального эффекта от комплексного лечения ожирения является санаторно-курортный этап, где использование всех вышеперечисленных факторов оптимально возможно. Цель исследования – изучить эффективность разработанного комплекса восстановительного лечения у детей с ожирением и МС.
Материалы и методы исследования
В исследование были включены 129 пациентов с ожирением I–III степени в возрасте 7–16 лет. Все обследованные дети были условно разделены на 2 группы. В 1-ю группу вошли 108 детей с нормальными показателями АД и с индексом ИР НОМА-R<2,7, свидетельствующим о сохраненной чувствительности к инсулину [12]. Во 2-ю группу вошли 24 пациента с подтвержденной ИР натощак (НОМА-R>2,7) и с показателями АД выше 95-го перцентиля для соответствующего пола и возраста. Диагноз ожирения ставили согласно классификации в зависимости от избытка МТ [1] и индекса МТ (ИМТ) с помощью таблиц T. Соle [13]. Диагноз МС устанавливали на основании модифицированных критериев для детей и подростков [14]. В контрольную группу вошли 10 практически здоровых детей (средний возраст 13,8±0,1 лет). Оценку уровня АД проводили в соответствие с рекомендациями рабочей группы по контролю гипертензии у детей и подростков с учетом возраста, роста и пола по центильным таблицам «Национальной образовательной программы по повышенному артериальному давлению», рекомендованным для оценки в России экспертами Всероссийского научного общества кардиологов и ассоциации детских кардиологов. Переносимость физических нагрузок оценивали по данным велоэргометрической пробы. Определяли гормональные (уровень инсулина натощак, уровень кортизола и лептина) и лабораторные (уровень глюкозы натощак, уровень ОХС, триацилглицеридов – ТГ, ХС липопротеидов высокой плотности – ХСЛПВП) параметры. Концентрацию глюкозы в крови определяли глюкозооксидантным методом с использованием тест-системы «Новоглюк-К, М» (ЗАО «Вектор-Бей», г. Новосибирск). Содержание ТГ, ОХС и ХС ЛПВП определяли энзиматическим колометрическим методом (тест-системы производства ООО «Ольвекс Диагностикум», СПб.). Уровень инсулина и лептина в крови определяли методом ИФА с помощью набора «Diagnostic System Laboratories», кортизол – набора «Стероид ИФА – кортизол». ИР оценивали по косвенным показателям – базальному уровню инсулина в крови и малой модели гомеостаза с определением параметра НОМА-R, вычисляемого по формуле: УГН
(уровень глюкозы натощак, ммоль/л) УИН (уровень инсулина натощак, мЕД/л)/22,5 [12]. Активность АПФ определяли по скорости гидролиза субстрата – N-[3-(2-фурил)-акрилоил]-L-фенилаланил-глицилглицина [7, 8], активность КК – по скорости гидролиза N-бензо-иларгинилэтилового эфира [7, 8]. Активность α1ПИ и α2МГ изучали по торможению гидролиза N-бензоилар-гинилэтилового эфира трипсином [7, 8].
Все пациенты получали лечение в течение 24 дней в детском отделении ФГУ «Томский НИИ курортологии и физиотерапии» Росздрава, включающее диету № 5 [15], разгрузочные дни 1 раз в неделю (кефирно-творожный, яблочный) с калоражем 1000–1200 ккал/сут, физические упражнения с индивидуальным дозированием физической нагрузки ежедневно, душ Шарко через день № 10, электросон по седативной методике № 10, ручной массаж воротниковой зоны и участков с избыточным отложением жира № 10, индивидуальные и групповые занятия с психологом ежедневно.
Чувство голода и неудовлетворенности качеством питания являют собой существенную проблему для пациента – часто ведут к психоэмоциональному напряжению, депрессии и побуждают пациента досрочно прекратить соблюдение диеты [1, 15]. Кроме того, у некоторых пациентов стимулом к приему пищи становится не чувство голода, а эмоциональный дискомфорт, что приводит к дальнейшему увеличению МТ. В связи с данным фактом необходима помощь психолога при лечении данной категории пациентов [1, 15].
Для нормализации психоэмоциональной сферы дополнительно проводили занятия с психологом ежедневно по 45–60 мин в течение 21–24 дней. Как показывают многочисленные исследования, физические нагрузки стимулируют окисление жира, способствуют уменьшению массы висцеральной жировой ткани, улучшению чувствительности к инсулину, показателей липидного обмена, предохраняют потерю тощей МТ [1, 15–17]. ЛФК назначали с индивидуальным дозированием физической нагрузки, ежедневно, в первую половину дня продолжительностью 30–40 мин, 21–24 дня, с последующими рекомендациями занятий в амбулаторной группе 3–4 раза в неделю.
Сущность реабилитационных мероприятий заключается в применении комплекса, включающего диетотерапию, адекватные физические нагрузки, психокоррегирующие мероприятия и физиопроцедуры, направленные на коррекцию гипоталамо-гипофизарных нарушений, депрессивно-тревожных состояний (электросон), а также на повышение активности метаболических процессов в подкожно-жировой клетчатке и мышцах (физические нагрузки, водные процедуры).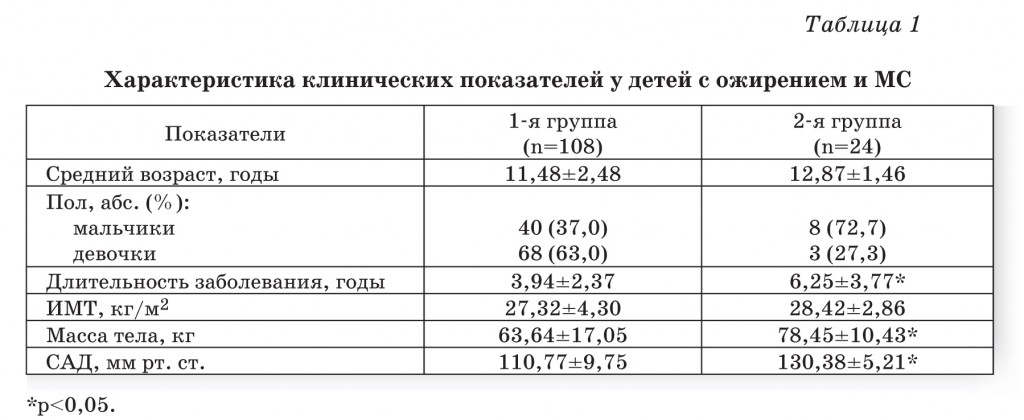
Душ Шарко (зоны воздействия: задняя поверхность бедер, ягодицы, передняя поверхность бедер, передняя брюшная стенка – места наибольшего отложения жира) относится к струевым, вызывает раздражение струями воды многочисленных механорецепторов и термочувствительных структур. Активирует центры вегетативной нервной системы, подкорковых структур, что приводит к стимуляции трофических процессов в организме, подкожной жировой клетчатке [10, 11, 18].
Электросон назначают для лечебного воздействия импульсами тока прямоугольной формы, частотой 10–20 Гц, силой тока до 1–2 мА, на гипногенные структуры головного мозга. Выбранная частота имеет седативный эффект на ЦНС, что является необходимым для лечения больных ожирением. Данные токи воздействуют на центры вегетативной и эндокринной систем, регулируют деятельность внутренних органов и тканей, активируют их трофику. Такие токи восстанавливают нарушенный при ожирении углеводный, липидный, минеральный, водный обмены в организме [10, 11, 18]. Продолжительность проводимых ежедневно процедур 30–40 мин, с возможным последующим сном, курс № 10–12. Статистический анализ данных проводили с использованием пакета программ SPSS 13.0 for Windows 9x. Определяли значения средней, ошибки средней, достоверность отличий между изучаемыми группами. Достоверным считали уровень значимости р<0,05.
Результаты и их обсуждение
Сравнительный анализ клинико-лабораторных характеристик детей 1-й и 2-й групп (табл. 1 и 2) позволил выявить особенности каждой категории пациентов. Возраст детей и давность заболевания были наибольшими и статистически отличались у детей 2-й группы. Выявленные изменения у детей 2-й группы свидетельствовали о формировании у них МС (абдоминальное ожирение, ИР, нарушение исследования указывали на увеличение активности КК у детей 1-й группы в 2,4 раза и 2-й группы – в 3,3 раза по сравнению с группой здоровых (табл. 2). При МС активность данного показателя была выше, чем при ожирении со статистически значимой разницей. При этом активность α1ПИ у детей с МС достоверно отличалась от показателей в группе здоровых детей. Значения активности АПФ не имели значимых различий между исследуемыми группами, но превышали контрольные значения (р<0,05). В целом, при МС у детей с ожирением отмечаются более выраженные нарушения состояния протеолитических вазоактивных систем
за счет увеличения активности КК, что связано с повышенной потребностью в ангиогенезе увеличивающейся жировой ткани и носит компенсаторный характер [6]. Возможно, сопряженное повышение активности АПФ отражает реакцию на повышение активности КК и обусловлено ростом ИР, что клинически проявляется формированием АГ. После курса лечения редукция МТ у детей 1-й группы составила 3,01±1,99 кг, 2-й группы – 2,82±1,96 кг. Все дети отмечали улучшение самочувствия и хорошую переносимость лечения. Регистрировали снижение среднего уровня систолического АД (САД) у детей 2-й группы с 130,38±5,21 до 118,0±3,01 мм рт. ст. (р<0,05). Средний уровень диастолического АД (ДАД) в группах не превышал контрольных значений. Во всех группах, по данным велоэргометрии, отмечали снижение толерантности к физическим нагрузкам по сравнению со здоровыми детьми (р<0,05), у которых этот показатель составил 92,1±3,12 Вт. Межгрупповые показатели толерантности к физическим нагрузкам статистически не отличались между собой и составили 74,77±14,88, 79,36±8,66 и 71,51±10,22 Вт соответственно. После комплекса реабилитации толерантность к физическим нагрузкам во всех группах возрастала (р<0,05), достигая значений здоровых детей (в 1-й группе – 89,46±14,92 Вт (19%), во 2-й группе –84,47±9,3 Вт (18%)).
Уровень глюкозы и инсулина у детей 2-й группы отличался от показателей детей 1-й группы (табл. 2). При этом на фоне лечения отмечалось снижение уровня глюкозы у детей 2-й группы (р<0,05). Индекс НОМА-R в этой группе также уменьшался после лечения с 3,72±0,29 до 3,34±0,34, что свидетельствовало о снижении ИР и повышении чувствительности тканей к инсулину. В 1-й группе (ожирение) частота дислипидемии (снижение концентрации ХС ЛПВП, увеличение ТГ) была зарегистрирована у 6 детей (5,56%), во 2-й группе – у всех детей. Средний уровень лептина достоверно не отличался в двух группах, но был достоверно выше показателей здоровых детей. В результате лечения во всех группах отмечалось значимое снижение этого показателя в обеих исследуемых группах пациентов (табл. 2).
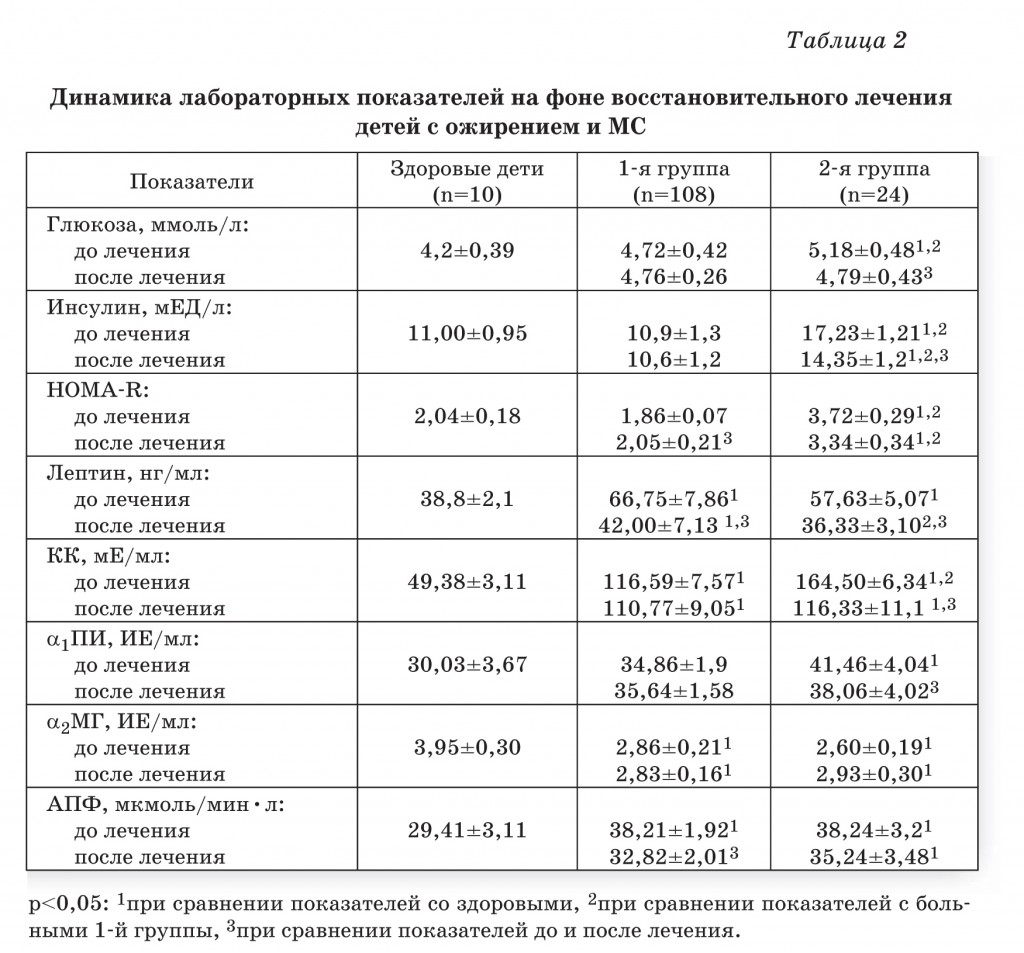
Изучение динамики состояния вазоактивных протеолитических систем выявило следующие особенности. Активность КК статистически значимо снижалась у детей с МС и не отличалась от значений у детей с ожирением (табл. 2). Однако в обеих группах данный показатель продолжал превышать контрольные значения. Активность АПФ понижалась у всех наблюдаемых детей, но в 1-й группе она достигала контрольных значений, а во 2-й группе оставалась выше показателей здоровых детей (р<0,05). Снижение данного показателя сопровождалось снижением ИР (индекс НОМА-R) (табл. 2). Предлагаемый комплекс лечения включает индивидуальные и групповые ежедневные занятия с психологом, что способствовало снижению уровня стресса, психоэмоционального напряжения, тревожности, а также положительно воздействовало на формирование изменения пищевого поведения (табл. 3).
Таким образом, для МС в детском и подростковом возрасте характерны выраженные нарушения со стороны обмена веществ, состояния вазоактивных систем, что определяет подходы к их реабилитации. Комплексное восстановительное лечение является эффективным методом реабилитации для данной категории пациентов. В силу выраженных гормонально-метаболических нарушений и состояния вазоактивных систем дети с ожирением и в большей мере с МС нуждаются в длительном динамическом наблюдении, повторных курсах восстановительной терапии и постоянной психологической поддержке.
Литература
1. Дедов И.И., Мельниченко Г.А. Ожирение: этиология, патогенез, клинические аспекты. М.: МИА, 2004.
2. Гинзбург М.М., Крюков Н.Н. Ожирение. Влияние на развитие метаболического синдрома. Профилактика и лечение. М.: Медпрактика, 2002.
3. Decsi T. Insulin resistance syndrome in children: pathophysiology and potential management strategies. Pediatric
Drugs. 2003; 5 (5): 291–299.
4. Гомазков О.А. Пептиды в кардиологии. Биохимия. Физиология. Патология. Информация. Анализ. М.: Материк Альфа, 2000: 143.
5. Яровая Г.А. Калликреин-кининовая система: новые факты и концепции (обзор). Вопр. мед. химии. 2001; 47 (1): 20–42.
6. Brooks D, Ohlestein E, Rubbolo R. Pharmacology of eprosartan – an angiotensin II receptor antagonism; exploring
hypothesis from trials. Am. Heart J. 1999; 138: 247–251.
7. Альтшулер Б.Ю., Ройтман А.П., Долгов В.В. и др. Влияние липопротеинов сыворотки крови на активность ангиотензинпревращающего фермента. Клин. лаб. диагностика. 2004; 11: 22–35.
8. Альтшулер Б.Ю., Ройтман А.П. Влияние гиперлипидемии на сывороточную активность ангиотензинпревращающего фермента. Клин. лаб. диагностика. 2001; 10: 11–15.
9. Физиотерапия и курортология. Под ред. В.М. Боголюбова. Книга 1. М.: Изд-во Бином, 2008.
10. Улащик В.С., Лукомский И.В. Общая физиотерапия. Мн.: Книжный дом, 2005: 512.
11. Пономаренко Г.Н. Лекция: Физиотерапия пациентов с ожирением. Физиотерапевт. 2008; 9: 55–65.
12. Малявская С.И., Дворяшина И.В., Терновская В.А. Метаболический инсулинрезистентный синдром: диагностика, клиническое значение, педиатрические аспекты. Архангельск: Северный государственный медицинский университет, 2004.
13. Calle EE, Thus MJ, Petrelli JM et al. Body-mass index and mortality in a prospective cohort of the US adults. N. Engl. J. Med. 1999; 341: 1097–1105.
14. Петеркова В.А., Васюкова О. Метаболический синдром у детей и подростков: критерии диагноза и особенности терапии. Врач. 2008; 5: 34–37.
15. Маслова Н.Г. Реабилитация детей с ожирением на основе общеобразовательной программы: Автореф. дисс. …канд. мед. наук. Уфа, 2005.
16. Волков Н.И., Несен Э.Н. и др. Биохимия мышечной деятельности. М.: Олимпийская литература, 2000: 208–210.
17. Дэниэл Г. Бессен, Роберт Кушнер. Избыточный вес и ожирение. Профилактика, диагностика и лечение: Пер. с англ. М.: ООО Изд-во Бином, 2004.
18. Медицинская реабилитация: Руководство для врачей. Под ред. В.А. Епифанова. М.: Медпресс-информ, 2005.
Авторы: Н.П. Степаненко, Е.И. Кондратьева, Г.А. Суханова, О.Б. Светлик, Н.В. Романова, Н.Н. Черепанова
ФГУН Томский научно-исследовательский институт курортологии и физиотерапии ФМБА, ГОУ ВПО Сибирский государственный медицинский университет Федерального агентства министерства здравоохранения и социального развития, г. Томск, РФ

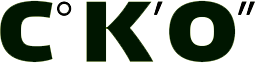





Актуальная тема! Молодцы! Продолжайте освещать её.